GMP确认与验证
我公司于今年完成了YWJ-250-II型全自动软胶囊机清洁验证、A-OW-142-01电子监管赋码系统确认、装盒生产线再确认等工作,质量管理部在协助这些工作进行的过程中发现部分人员对确认和验证区分的不够明确,那么,确认和验证的区别究竟在何?而2010版GMP条款第一百四十九条规定应当根据验证的结果确认工艺规程和操作规程。该条款是否混淆了确认和验证的定义?新版中的确认和验证定义是否科学?
对此我们进行了讨论:
1、根据新版术语释义,确认证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动。验证是证明任何操作规程(或方法)、生产工艺或系统能够达到预期结果的一系列活动。所以该条款将两者混为一谈,增加了大家对条款的误解。正解是根据验证的结果确定是否批准工艺规程和操作规程。验证只是证明工艺规程和操作规程的可靠性和重现性,而不是确认工艺参数。
2、条款对两者的定义欠妥,只是规定了对象的不同,而对其目的却表述的一模一样,都是证明达到预期结果。两者的区别恰恰就在目的上。确认是已经有了明确的要求或者标准,确认结果是证明对象与设计要求或标准的符合性,验证是已经有了明确的目的(确保产品质量),验证结果是证明对象(过程)的可靠性和重现性。
新版GMP明确了确认和验证的定义,确认和验证的范围和程度要通过风险评估来确定,并要用文件确定下来;验证和确认不是一次行为,是持续进行的,并遵循一定的生命周期。
随着新版GMP的正式颁布,制药企业面临着更大的机遇和挑战,验证工作提出了更高、更全面的要求。对于验证有以下几个新的特点:(以下内容来自《药品生产质量管理规范(2010年修订)培训教材》)
1.明确了确认和验证的定义:
1.1确认(Qualification)是证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动。就是说要用文件和记录的形式证明厂房、设施、设备得到满足的认定,确认可以在实际或模拟的使用条件下进行,它强调的是结果的正确性。十万级洁净度的环境是否能满足生产的需要,是要对生产过程来确认的。新版GMP规定企业的厂房、设施、设备和检验仪器应经过确认。
1.2验证(Validation)是证明任何操作规程(或方法)、生产工艺或系统能达到预期结果的一系列活动。就是说要用文件和记录的形式证明操作规程(或方法)、生产工艺或系统已达到要求的认定。验证的认定方式可以包括如变换方法计算、将新设计规范与已经证实的类似老设计规范进行比较,进行试验和演示、文件发布前进行评审,它强调的是过程的正确行。洁净厂房的洁净度是否达到十万级,是需要验证的,可以用测试的方法来验证。新版GMP规定应采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验。
2.确认和验证的范围和程度应经过风险评估(SIA)来确定:
风险评估就是量化测评某一事件或事物带来的影响或损失的可能程度。药品生产过程中不是所有的设备、系统、操作方法等都是都要确认和验证。我们要进行系统划分,回答系统影响性评估表(SIAF)中的问题,为所选择答案提供详细的依据,每份完成的系统表格均将能够充分地确定系统是“直接影响”、“间接影响”还是“无影响”。我们必须对直接影响系统进行确认和验证。然后对每个直接影响系统进行进行质量关键性评估,关键性评估将包括两个步骤:确定关键质量属性(CQA),确定关键工艺参数(CPP),之后对关键的属性和参数进行验证和确认,就解决了程度的问题。
3.验证要文件化:
首先要有验证主计划,明确验证的方针、组织、职责、待验证的设施、设备、系统和工艺的概述;可接受标准;文件格式(验证方案和报告的格式);计划和日程安排;变更控制;所采用的参考文献。保证所有的验证均能有效、持续的执行。
制定每一个验证的具体实施方案,包括目的、范围和系统描述、人员及职责分工、计划和日程安排、实施步骤及接受标准、偏差汇总、参考文献。根据方案逐步进行实施并做好记录,最后整理验证报告,包括验证的数据汇总,偏差描述、结论(含评价及建议),再验证范围和周期,最后验证小组组长批准验证报告。
4.验证生命周期。
验证和确认的第一阶段是从客户的URS开始,选择供应商,通过SIA和RA确定验证主计划(VMP);第二阶段是设计确认(DQ);第三阶段是安装测试(相当于FAT);第四阶段IQ、OQ和转交;第五阶段是PQ;第六阶段验证报告总结;第七阶段是系统使用与维护(变更、定期的验证回顾)。
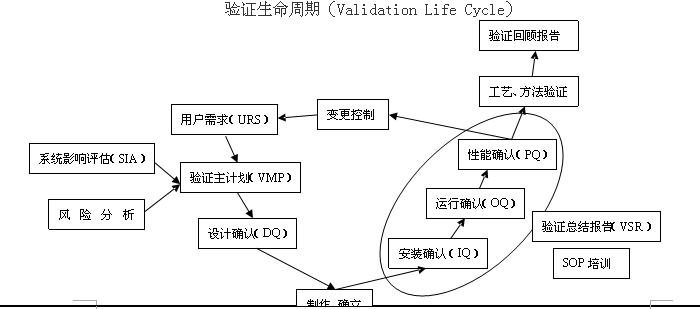
总之新版GMP明确指出厂房、设施、设备和检验仪器应经过确认,应采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验,并保持持续的验证状态。对验证和确认证不是一次性的行为,要根据产品质量回顾分析情况进行再验证。也就是说我们任何和质量有关的操作和标准都要有验证文件的支持,所有的变更和升版都是验证生命周期的一部分。
质量管理部:李东玉、吴萌


