249药品说明书修改,还有一大批在路上
▍2017年至今249个药品说明书修改,频次呈加快趋势
日前,国家药监局发布了《国家药品监督管理局关于修订血塞通注射剂和血栓通注射剂说明书的公告(2018年第46号)》,这是自2017年以来第38次、2018年至今第22次发布修改药品说明书的公告,可见,药品说明书的修改频次在不断加快。
自2017年以来,共有38个批次249个药品被修改,其中以化学药为主,主要是由于2017年7月5日关于氟喹诺酮类的药品说明书修改涉132个药品。
其中化学药20个批次179个药品;中成药17批次69个药品;生物制品1个批次1个药品。
但单从2018年来看,却以中成药为主。共计发布了23个批次75个药品,其中中成药12个批次54个药品,化学药10个批次20个药品。可见,在未来药品说明书的修改的重点对象将可能会是中成药为主,尤其是一些用量大、适应症广而禁忌、不良反应“尚不明确”或“尚无”的产品。
2017年1月至今药品说明书修订公告及涉及药品品种情况如下表:
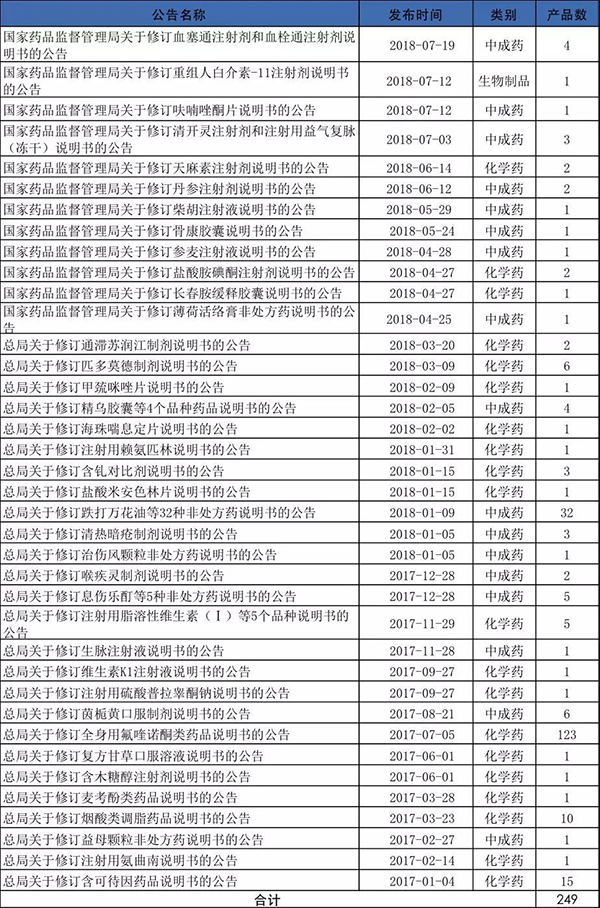
注:根据国家药监局公告整理,仅供参考
有一些药品说明书的修订会极大的减少用药人群,这些会对制药企业的销售带来影响,如柴胡注射液,在之前的临床实践中也有较大部分用于儿童,但在修改说明书后明确不可用于儿童,这类产品会对销售产生较大影响。还有一些药品,如血栓通注射液等品种增加禁忌为儿童禁用,因为这类药品在临床基本不用于儿童,所以影响相对较小。
▍药品说明书修改两大主要原因大揭秘
化学药药品说明主要包含安全性、有效性的重要科学数据、结论和信息,用以指导安全、合理使用药品;中成药药品说明书主要包含药品成份、性状、用法用量、禁忌、注意事项、药物相互作用等。所有药品说明书应当充分包含药品不良反应信息,要详细注明药品不良反应。
药品不良反应网络监测完善,还历史遗留旧账
随着国家用药监测网络的完善,药品不良反应反馈系统不断完善。我国药品注册中原来很多地标升国标的药品在转化评价过程中,药品的质量安全性与再评价工作都滞后或缺失,导致了目前上市销售的很多药品说明上的【禁忌】、【不良反应】项目为“尚不明确”,尤其是中成药,绝大多数药品在这两栏基本都是“尚不明确”。国家药品监督管理部门正在大力解决国家药品评审过程中历史性的遗留欠账问题,不断完善药品说明书。
控制药品用药风险,提升用药安全
2017年国家药品不良反应年度报告显示,通过药品说明书修订、《药品不良反应信息通报》、《药物警戒快讯》等公告显示,国家局通过日监测、周汇总、季度分析等工作机制对国家药品不良反应监测数据进行分析评价,深入挖掘药品风险信号,并采取相应风险管理措施。
儿童用药警示
目前由于儿童用药比较缺乏,很多药品均是儿童减半使用。但是国家药监局从儿童用药安全考虑,明确增加多个药品的“儿童禁用”要求。
▍还有大批药品在修改的路上
根据今年药品说明书修改的趋势来看,重点在中药注射剂,且修改的重点针对内容是针对药物相互作用、禁忌“尚不明确”或“尚无”,且大多是针对中药注射剂。
当然,也不排除由于其他药品由于在上市后副作用监控统计有了新的发现,或者提示新的使用风险、警示等,也会导致药品说明书的修改。
▍制药企业该如何应对?
药品获批上市销售只是一个新的起点,制药企业需要在后续的临床使用中不断发现药品存在的问题,不断完善和提升药品质量和疗效,规范药品的临床使用。
要应对药品说明书的修改,制药企业主要应该从以下几方面努力:
一是确保药品研发过程的规范性、科学性、严谨性。
只有在药品研发过程中确保每一个阶段、每一个流程的规范、科学和严谨,才能保证药品的各项指标不存在问题,才能在药品说明书中的每一栏都有据可查。只有在研发过程中的每一步做到规范、科学严谨才能保证药品说明书的编写符合国家药品说明书的编写原则和要求,保证说明书的严谨;也只有这样才能避免在药品获批上市后降低出现纰漏的可能,避免说明书被修订。
二是切实、积极大力推进药品再评价工作。
根据药学的最新学术水平,从药理学、药剂学、临床医学、药物流行病学、药物经济学及药物政策等主要方面,对已正式批准上市的药品在社会人群中的疗效(有效性)、不良反应(安全性)、用药方案、稳定性及经济学等是否符合安全、有效、经济的合理用药原则作出科学的评议和估计。而不是一些中药注射剂做的所谓的安全性再评价只是营销性质的评价,缺少具有说服力的临床追踪数据。
三是积极做出主动修改说明书的准备。
药品生产企业根据药品上市后的安全性、有效性情况记录及时修改说明书,不断完善药品全生命周期的质量管理。对已确认有重大质量风险的,制药企业应及时按照监管部门的要求,及时修订说明书并向医疗使用单位发出风险警示,要求用前严格检查,防止不合格或者缺陷药品用于临床治疗。


